活動報告・情報提供REPORT & INFORMATION
2024.10.01
医療・疾患情報
- #リアルワールドデータ
- #RWD
- #エビデンス
知っておきたい リアルワールドデータと医療の深い関係
近年、リアルワールドデータ(RWD)やリアルワールドエビデンス(RWE)という言葉が医療業界で使われるようになりました。馴染みのない単語かもしれませんが、より良い治療法の開発、特に希少疾患治療薬の開発ではRWDが重要な役割を果たします。本記事では、この言葉がどのようなものなのか解説します。
1. リアルワールドデータとは?
アメリカの政府機関であり、医薬品などの審査を行っている米国食品医薬品局(FDA: Food and Drug Administration)によると、RWDとRWEは以下のように定義されています1)。
リアルワールドデータ(RWD):
さまざまな情報源から日常的に収集された、患者の健康状態や医療の提供に関するデータ
リアルワールドエビデンス(RWE):
RWDの分析から得られた医療製品の使用方法や潜在的な利点・リスクに関する臨床的エビデンス(裏付け)
RWDの情報源は、電子カルテ、医療請求のデータ、疾患別の治療経過などをまとめている管理記録(データベースなど)、健康調査およびアプリのデータなどです。IT技術の進歩に伴い情報源は多岐にわたっており、情報を幅広く収集することができるようになりました。
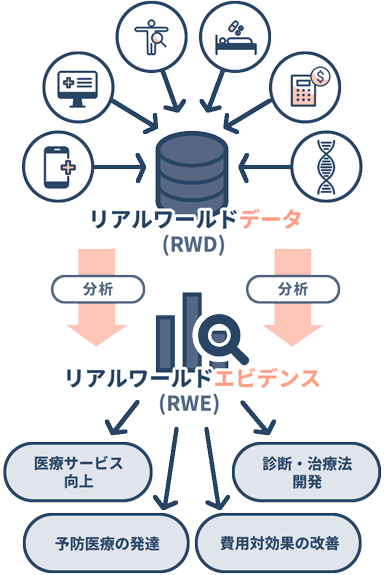
臨床試験(治験)は決められたルールの中で情報を収集する一方で、RWDは実際の使用実態からさまざまな状況のデータが集まったものです。一つひとつのデータの信頼度は低いものの、データの数が多く、背景も多様であることから、使用する目的によっては非常に有意義なデータであるとされています。
ここまで聞くと、「自分のデータが勝手に使われているのでは」と懸念を抱く方もいるのではないでしょうか?実は、RWDを収集・利用する際は、個人情報に十分配慮した上で実施されています。
例えば、医師や製薬会社が研究開発に用いる患者さんの情報を直接集める場合、必ず患者さんに利用目的を伝え、同意を取得する必要があります。また、企業・団体が利用できるデータベースでは、個人の特定につながる情報は削除・加工されており、そのデータが誰のものか分からないように配慮されています。
2. リアルワールドデータは何に使われるの?
FDAによる医療機器へのRWEの利用ガイドラインの改訂案によると、RWDを活用する場面として、以下の例を挙げています3)。これらは医療機器に焦点を当てた活用例ですが、医薬品でも同様の場面で活用できると考えられます。
- 既存のエビデンスの補足として、未承認製品の評価のサポートに用いる
- 臨床試験の外部比較対照群として
- 臨床試験(単群試験)の評価の目標値を設定するため
- 適応症または禁忌の拡大のための参照データ
- 製品の添付文書を改訂する際の参考として
- 長期的な安全性・有効性の評価
- 希少疾患の治療に使う製品の、さまざまな使用条件での評価
- 市販後の有効性・安全性情報の収集
- 承認条件が付いた製品の追加調査
各国政府もRWDを活用しており、薬事制度や保険制度、産業政策を検討する際の重要な参考情報として用いられています。
また、欧米では医薬品開発にRWDを利用する際のガイドラインも定められており、RWDが薬剤の有効性・安全性を確かめるための比較対照のひとつとして認識されています1)2)。
特に希少疾患領域では、患者さんの人数自体が少ないため、医薬品の臨床試験において有効性・安全性を示すことが難しい場合があり、少しでも多くの疾患情報を得るための重要な情報源としてRWDが活用されています。しかし、医薬品の効果を示すためにRWDと比較する場合は、臨床試験と同程度のデータ量が求められるため4)、患者さんの疾患、治療内容、治療経過を管理するデータベースなどのより一層の充実が求められています。
データの利用にあたって、個人情報を守らなければいけない反面、厳しすぎると利用が進まないという難しさがあり、欧米と比べると日本はRWD/RWEの利用に課題があると言われています5)。例えば、米国ではRWEの活用90事例の詳細が公表されており事例集として市場から活用されていることと比較し、日本では国内にあるRWDを活かしきれていないとされておりました。
しかし、厚生労働省が提供する、「NDB(ナショナルデータベース)」や医薬品医療機器総合機構が管理・運営をする「MID-NET」のような網羅的なデータベースの他、難病に特化した「難病プラットフォーム」や各疾患に特化したものなど、近年は日本でもさまざまなデータベースの整備が進んでいます。また、「全国医療情報プラットフォーム」7)が整備中※1であり、国内に大量にあるRWDの連結・統合に向けて取り組みが始まっており、より活発なRWDの利活用が期待されます。
リアルワールドデータを構成するのは、患者さんの日々の診察記録や1枚のアンケートなどです。データを結集することで、さらなる医療の質の向上や社会の発展につながっていきます。
※1 記事作成時点(2024年8月26日)

参考資料
- U.S. Food & Drugs, Considerations for the Use of Real-World Data and Real-World Evidence to Support Regulatory Decision-Making for Drug.
(https://www.fda.gov/media/171667/download)(2024年8月5日閲覧) - European Medical Agency, Real-world evidence provided by EMA,
(https://www.ema.europa.eu/en/documents/other/guide-real-world-evidence-provided-ema-support-regulatory-decision-making_en.pdf)(2024年8月5日閲覧) - U.S. Food & Drugs, Draft: Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices,
(https://www.fda.gov/regulatory-information/search-fda-guidance-documents/draft-use-real-world-evidence-support-regulatory-decision-making-medical-devices)(2024年8月5日閲覧) - 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律,
(https://www.mhlw.go.jp/web/t_doc?dataId=81004000&dataType=0&pageNo=1)(2024年8月5日閲覧) - 国立研究開発法人日本医療研究開発機構ホームページ, 医療機器開発におけるリアルワールドデータ(RWD)の活用事例に関する調査,
(https://www.amed.go.jp/content/000128593.pdf)(2024年8月27日閲覧) - U.S. Food & Drugs, Examples of Real-World Evidence Used in Medical Device Regulatory Decisions,
(https://www.fda.gov/media/146258/download)(2024年8月27日閲覧) - 厚生労働省, 医療 DX 推進に関する意見交換会(2023年9月8日),
(https://www.mhlw.go.jp/content/10808000/001144379.pdf)(2024年8月27日閲覧)

