活動報告・情報提供REPORT & INFORMATION
2024.06.03
お役立ち情報
- #新薬開発
- #治験
- #臨床試験
新しいお薬ができるまでの道のり
体調の悪いときや病気に罹ってしまったときに、お世話になっているお薬は
どのくらい長い時間をかけて、どのように開発されているのか、皆さんご存知ですか?
実は、日本において「新薬」を
ひとつ開発するには約9~17年もの時間と、
数百億円の開発費がかかると言われています。
*1 Chemistry, Manufacturing and Controlの略
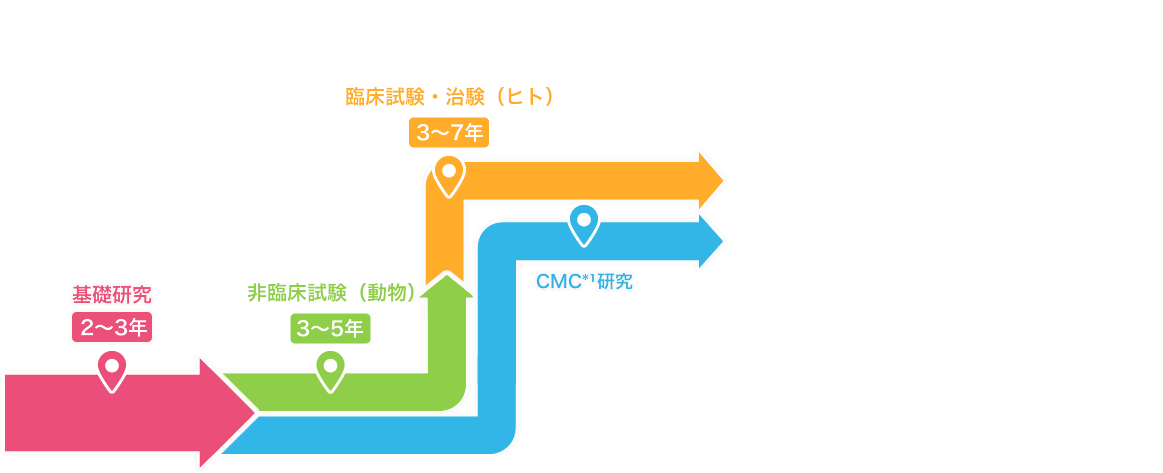
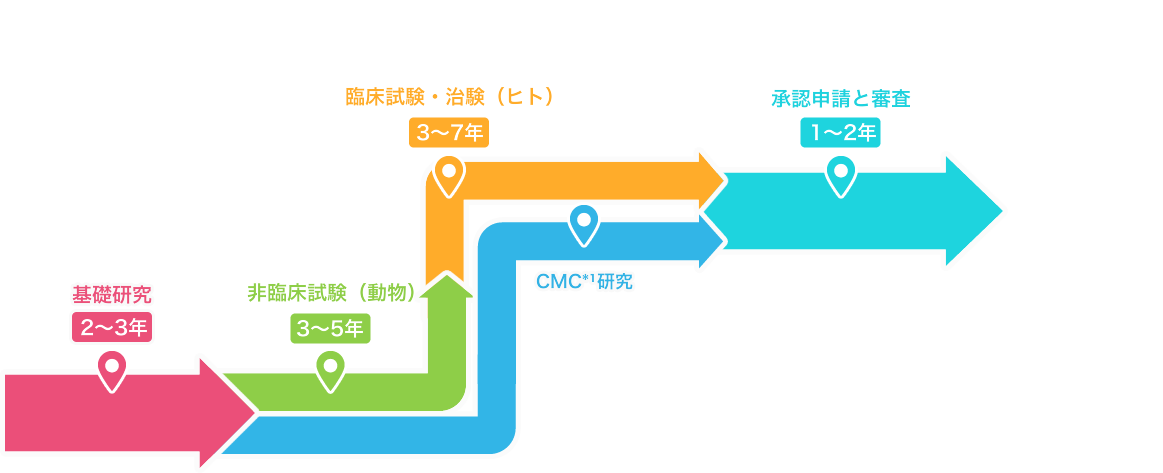
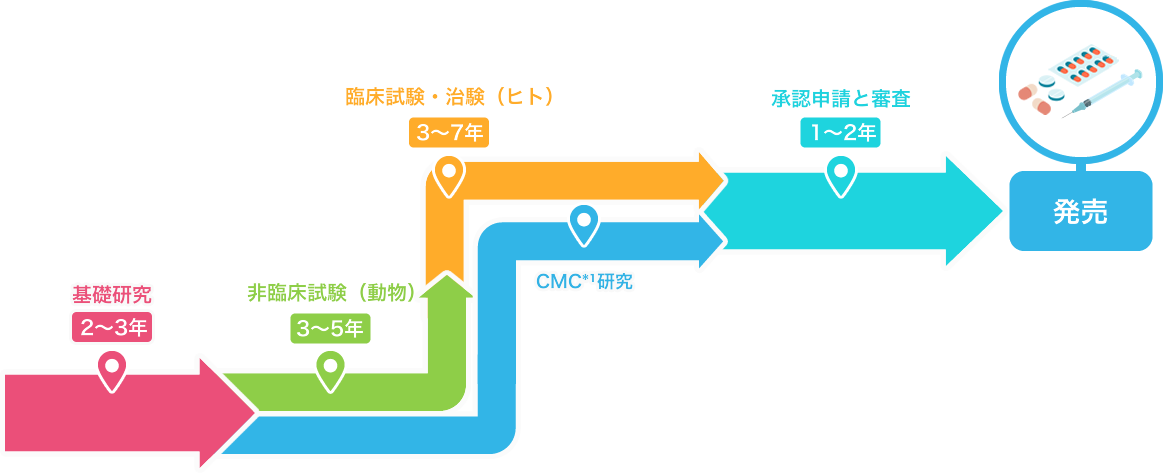
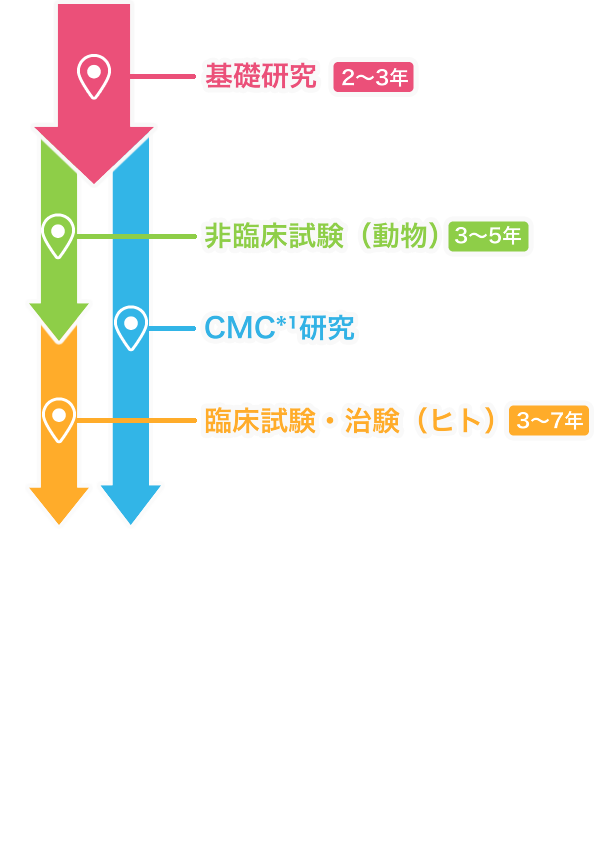
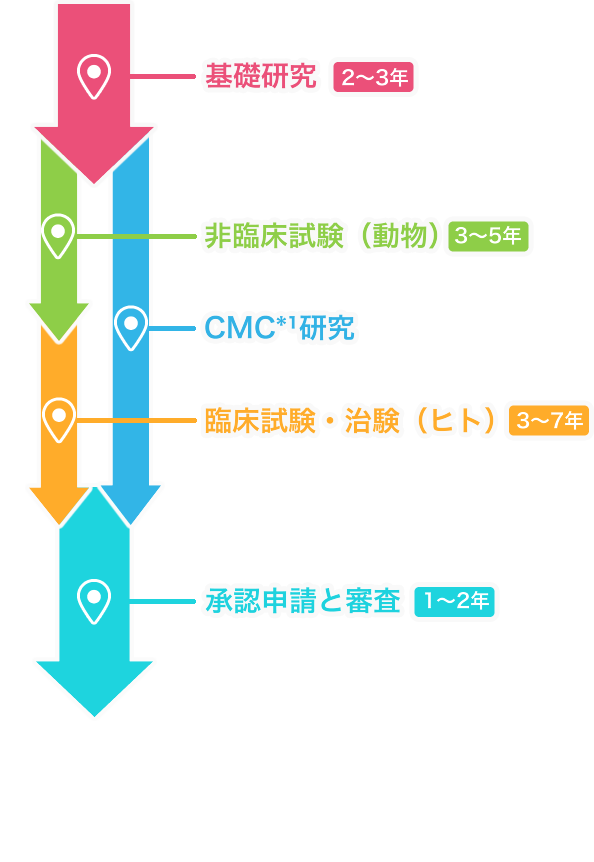
基礎研究2~3年
お薬の開発は、患者さんの症状やどのような苦しみを抱えているのかを調べお薬のもと(物質・成分)を発見し、化学的につくり出すための研究から始まります。
お薬のもとは、植物や微生物などから抽出したり、物質を化学的に合成したりすることで見つけ出します。
研究者たちは、長い時間をかけて試行錯誤し、新しいお薬の候補を探します。

非臨床試験(動物・細胞)3~5年
動物や培養細胞を用いて、新しいお薬の候補物質の有効性と安全性を研究します。

臨床試験・治験(ヒト)3~7年
必要な非臨床試験を通過した新しいお薬の候補(治験薬)が、実際にヒトに対しても有用かどうかを確認します。

-
第 1 相
フェーズⅠ少数の健康成人志願者で安全性を確認
-
第 2 相
フェーズⅡ第1相で新しいお薬の候補の安全性が示唆された後、少数の患者さん(同意の上)で有効性・安全性を確認
-
第 3 相
フェーズⅢ第1相、第2相で有効性、安全性が見込まれたお薬の候補について、
多数の患者さん(同意の上)で新薬として価値があるかを確認
CMC研究
新しいお薬の候補の
品質評価、安定性試験、製造方法の開発などを行います。

新しいお薬の候補を、ヒトにとって安全かつ有効であり常に高品質・安定的に製造するためには下記のような一連のプロセスの確認が必要です。
- 原薬を安定的に製造できる
技術を研究 - 患者さんに製品として
使用してもらうため
製剤設計
(外観・味・大きさ)
を検討 - 品質保証・品質管理
製造販売承認と審査1~2年
治験にて有効性・安全性・品質が確認された後、厚生労働省に対して製造販売承認を得るための申請を行います。
PMDA*²の審査を経て承認された後、新薬として製造・発売することができます。
*2 独立行政法人 医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency)の略
発売
- 非臨床試験・臨床試験とは
- CMC研究とは
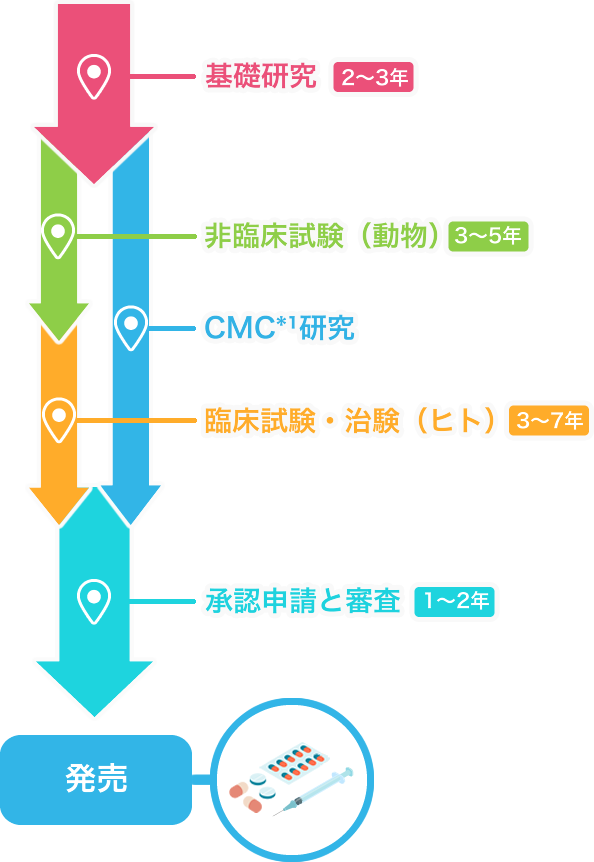
基礎研究2~3年
お薬の開発は、患者さんの症状やどのような苦しみを抱えているのかを調べお薬のもと(物質・成分)を発見し、化学的につくり出すための研究から始まります。
お薬のもとは、植物や微生物などから抽出したり、物質を化学的に合成したりすることで見つけ出します。
研究者たちは、長い時間をかけて試行錯誤し、新しいお薬の候補を探します。

非臨床試験(動物・細胞)3~5年
動物や培養細胞を用いて、新しいお薬の候補物質の有効性と安全性を研究します。

臨床試験・治験(ヒト)3~7年
必要な非臨床試験を通過した新しいお薬の候補(治験薬)が、実際にヒトに対しても有用かどうかを確認します。

-
第 1 相
フェーズⅠ少数の健康成人志願者で安全性を確認
-
第 2 相
フェーズⅡ第1相で新しいお薬の候補の安全性が示唆された後、少数の患者さん(同意の上)で有効性・安全性を確認
-
第 3 相
フェーズⅢ第1相、第2相で有効性、安全性が見込まれたお薬の候補について、
多数の患者さん(同意の上)で新薬として価値があるかを確認
製造販売承認と審査1~2年
治験にて有効性・安全性・品質が確認された後、厚生労働省に対して製造販売承認を得るための申請を行います。
PMDA*²の審査を経て承認された後、新薬として製造・発売することができます。
*2 独立行政法人 医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency)の略

発売

- 非臨床試験・臨床試験とは
- CMC研究とは
参考資料
- 第7回医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会資料「医薬品産業の現状」.厚生労働省.
(https://www.mhlw.go.jp/content/10807000/001036959.pdf)(2024年3月28日閲覧) - てきすとぶっく 製薬産業 2022-2023. 日本製薬工業協会. (https://www.jpma.or.jp/news_room/issue/textbook/index.html)(2023年12月11日閲覧)
- 治験ってなあに?. 国立成育医療研究センター.(https://www.ncchd.go.jp/scholar/clinical/chiken/patient/about.html)(2023年11月22日閲覧)